中国创新药发展迅猛,同靶点影响试验效率
- 分类:行业动态
- 作者:
- 来源:生物制药小编
- 发布时间:2022-05-20
- 访问量:171
【概要描述】中国的监管改革促进了本土医疗创新。获批IND和获批NDA数量的趋势以及这些批准所花费的时间表明,这些变更的影响通常是有益的。尽管如此,具有相同靶点的多个产品的聚集和低效的临床试验过程将影响真正有意义的创新药物从IND到NDA批准的进程。
中国创新药发展迅猛,同靶点影响试验效率
【概要描述】中国的监管改革促进了本土医疗创新。获批IND和获批NDA数量的趋势以及这些批准所花费的时间表明,这些变更的影响通常是有益的。尽管如此,具有相同靶点的多个产品的聚集和低效的临床试验过程将影响真正有意义的创新药物从IND到NDA批准的进程。
- 分类:行业动态
- 作者:
- 来源:生物制药小编
- 发布时间:2022-05-20
- 访问量:171
在过去十年中,由于监管改革,中国新药的临床开发和监管审查过程发生了实质性变化。这些改革旨在鼓励开发创新产品,特别是罕见、严重或危及生命的疾病,并确保患者及时获得这些治疗。

2010-2020年新药趋势
首次IND申请数量急剧增加。2010年至2020年,共提交了1636个创新药的首次IND申请,年均增长率为32%(图1a)。其中,1 410种药物(86%)来自689家当地公司。值得注意的是,2017年创新药首次IND申报数量较2016年增长78%,其中化学药品和治疗用生物制品分别增长60%和159%。
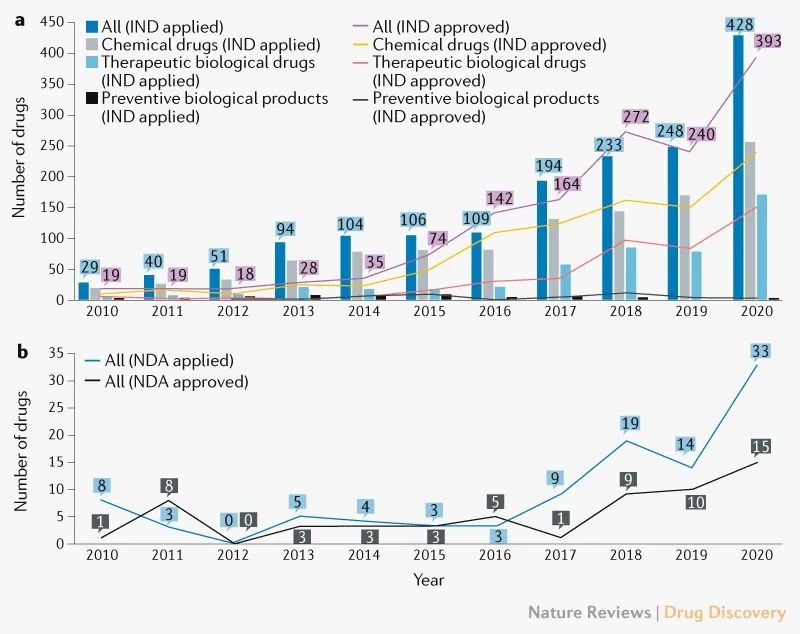
图1|中国创新药年度IND和NDA数量
在1,466例完成的首次IND审查中,1,404例(96%)获得批准。拒绝原因主要包括申报后缺乏研究信息导致沟通无效、药物临床获益风险比不合理、违背临床诊断基本原则等。首次获批IND的创新药数量每年增加35%,其中2016年首次获批IND的创新药明显增加。
申报和批准的创新药首次IND数量显著增加,与2015年7月中国监管改革措施出台的时间相一致,缓解了申报积压,鼓励了医药创新。
创新药物的获批NDA数量较少,但在不断增长。2010年至2020年提交了101个创新药的NDA,58个创新药获得批准。近年来,提交和批准的NDA数量普遍在增加(图1b),自2015年7月以来,58个批准的创新药物中有42个(72%)获得批准。
在完成的66项首次NDA审查中,58项(88%)获得批准。拒绝的主要原因是药物或临床研究设计存在重大缺陷,不同发育阶段使用的试验样品不一致,检查中发现的临床试验数据不真实。
在58个获批的创新药中,37个为中国国家药品监督管理局(NMPA)批准的新分子实体(NME),而21个为国外已批准或上市的药物,或传统疫苗、血液制品、细胞因子等。此外,14例(24%)为孤儿药,其中13例根据美国FDA的标准有资格作为孤儿药。再者,40个创新药(69%)获得优先审评,其中35个(88%)在2015年7月后获得批准。数据显示,2015年8月出台的优先审评等监管改革措施,鼓励组织创新。
肿瘤是创新药物的主要领域,大多数处于早期开发阶段。首次IND申请获批的创新药物的主要治疗类别为肿瘤(864,62%)、感染(166,12%)、内分泌紊乱(72,5%)和心血管疾病(60,4%)。2016年首次IND申请获批的肿瘤药物数量明显增加,增长率为133%。
在首次IND申请获批的创新药中,705个(50%)至少达到I期,而286个(20%)和108个(8%)药物分别达到II期和III期。大多数抗癌药物(57%)尚未进展超过I期(图2a)。
图2|创新药发展状况
我国主要处于快速跟踪、逐步创新阶段,获批NDA的创新药物只有3个‘首创’:苯维莫德、低聚甘露糖酸钠和罗沙司他。有超过40种靶向EGFR、PDL1和HER2的药物(图2b),其中EGFR的获批药物数量(4种)和已达到临床试验的药物数量(64种)最高。多个靶点和适应症相同的药物会降低创新效率。
IND和NDA审批速度提高,但临床试验速度没有提高。如图3所示,改革后阶段(2015年7月至2020年12月)的IND批准时间比改革前阶段(2010年1月至2015年6月)短414天(87天vs. 501天)。同样,改革后阶段药品的NDA批准阶段比改革前阶段短441天(483天与924天)。
图3|2010-2020年期间批准的创新药物的时间
2018年7月,国家药品监督管理局将开始药物临床试验的审批流程调整为默示许可制度。就整个临床试验阶段的时长(2,572天与2,688天)而言,两个研究阶段的差异不显著,而改革后阶段IND批准后入组临床试验首例受试者的时间比改革前阶段长59天(328天vs 269天)。提高临床试验效率是我国鼓励创新的重要改革方向。但这受伦理审查效率、研究者经验和临床试验资源等多因素的影响,需要对国家临床试验能力进行战略升级来解决。再者,目前靶点和适应症相同的药物集中在同一临床试验阶段,加重了对临床试验效率的影响。
中国的监管改革促进了本土医疗创新。获批IND和获批NDA数量的趋势以及这些批准所花费的时间表明,这些变更的影响通常是有益的。尽管如此,具有相同靶点的多个产品的聚集和低效的临床试验过程将影响真正有意义的创新药物从IND到NDA批准的进程。
参考文献:
https://www.nature.com/articles/d41573-022-00077-3
扫二维码用手机看
推荐新闻
Copyright 2021 北京球盟会生物科技股份有限公司 京ICP备********号
网站建设:中企动力 北二分



